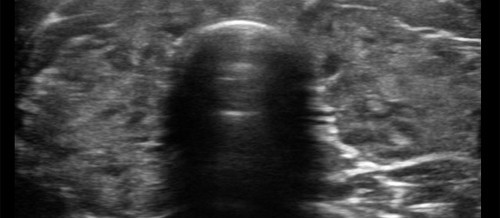
La tiroidite cronica di Hashimoto è un processo infiammatorio autoimmune della tiroide.
La tiroidite cronica di Hashimoto, è una particolare forma di tiroidite caratterizzata da una cronica infiltrazione linfocitaria. Tale patologia, frequentemente silente, porta spesso ad una graduale, ma progressiva e irreversibile ipofunzione della tiroide. Quando la produzione di ormone tiroideo diventa insufficiente si instaura un quadro di ipotiroidismo.
EPIDEMIOLOGIA
E’ la più frequente delle patologie tiroidee ed è la causa più frequente di ipotiroidismo nelle aree del mondo con un sufficiente apporto di iodio, mentre nelle aree a carenza iodica la tiroidite cronica è ancora oggi una malattia relativamente rara.
Nelle donne l’incidenza è di 3,5 casi per 1000 abitanti l’anno negli uomini, invece, è più bassa (0,8 casi per 1000 abitanti l’anno). La differente distribuzione tra i sessi è meno evidente per la variante fibrosa.
FISIOPATOLOGIA
Alla base della patologia vi è un processo infiammatorio autoimmune che porta alla distruzione dei follicoli. Sia l’immunità cellulo-mediata che anticorpo-mediata sono chiamate in causa nella patogenesi della malattia.
Le cellule infiammatorie predominanti nel tessuto tiroideo sono linfociti B e T. I linfociti T helper vengono attivati contro le cellule tiroidee. Il meccanismo di attivazione dei linfociti non è noto ma, probabilmente, può avvenire per microchimerismo molecolare da parte di agenti esogeni o per attivazione diretta da parte di tireociti che espongono, in modo aberrante sulla superficie cellulare, delle molecole in grado di provocare l’attivazione dei linfociti. Una volta attivato, il linfocita T helper produce diverse citochine che perpetuano e rendono cronico il processo infiammatorio autoimmune.
Alcune di queste citochine inducono, tra l’altro, l’espressione di fas sulle cellule tiroidee. E poichè i linfociti T citotossici esprimono in superficie il fas ligand, quest’ ultimo, interagendo con il fas espresso dai tireociti, determina la morte apoptotica dei tireociti.
Quindi, il processo infiammatorio e l’ infiltrazione linfocitaria (da cui il nome di tiroidite linfocitica) determinano una riduzione della sintesi degli ormoni tiroidei, tramite la distruzione apoptotica delle cellule tiroidee. Si determina così, contemporaneamente, una riduzione della capacità di organificare lo iodio intratiroideo e un rilascio di iodioproteine (tireoglobulina) da parte dei tireociti lisati.
Tuttavia, affinchè si manifesti l’ipotiroidismo, è necessaria la distruzione di almeno il 90% del tessuto tiroideo.
Il meccanismo umorale, invece sembra avere un ruolo di secondo piano. Infatti, a differenza di quanto accade in vitro, gli anticorpi anti TPO sembrano incapaci di produrre un danno al tireocita in vivo. Inoltre, a conferma di ciò, gli anticorpi anti TPO che passano la placenta dalla madre al feto non provocano alcun danno alla tiroide fetale. Gli anticorpi anti TSH-R bloccanti, al contrario, possono bloccare transitoriamente anche la tiroide fetale, suggerendo l’ ipotesi che possano avere un ruolo di primaria importanza nella patogenesi delle tiroiditi autoimmuni.
Classicamente gli autoanticorpi che si riscontrano nella tiroidite cronica sono quelli anti tireoperossidasi (Ab anti-TPO) (95%) e anti tireoglobulina (Ab anti-Tg)(50-60%).
Possono occasionalmente comparire anche degli anticorpi anti TSH-recettore bloccanti (TSHRblockingAb), responsabili della variante atrofica (detta mixedema idiopatico o morbo di Gull) o ancora più raramente anticorpi anti TSH-recettore stimolanti (TSHRAb), responsabili del transitorio, o a volte permanente, ipertiroidismo che raramente è stato riscontrato in pazienti affetti da tiroidite di Hashimoto (hashitossicosi o ipertiroidite).
ANATOMIA PATOLOGICA
Il quadro istologico può variare in base all’estensione e all’ entità del processo infiammatorio ma è sostanzialmente caratterizzato da un diffuso infiltrato linfocitario, che in alcuni casi possono formare dei tipici follicoli linfoidi con tanto di centro germinale. Il grado di infiltrazione linfocitaria correla con il livello di anticorpi circolanti. La colloide è spesso sparsa. Si osserva tra l’altro fibrosi, soprattutto nelle tiroiditi di vecchia data, e obliterazione dei follicoli tiroidei. Frequente è la rottura della membrana basale follicolare e la distruzione dei tireociti, mentre le restanti cellule epiteliali sono solitamente piu’ grandi della norma, chiare, mostrano la presenza di strutture ossifile nel citoplasma (mitocondri), sono chiamate cellule Askanazy, e sono patognomoniche della tiroidite cronica.
Istologicamente possono essere distinte due varianti:
1) Variante ossifila: si caratterizza per la prevalenza di cellule ossifile, per una prevalenza dell’infiltrazione linfocitaria con formazione di follicoli rispetto alla fibrosi;
2) Variante fibrosa: l’ infiltrato è costituito prevalentemente da plasmacellule e la fibrosi è prevalente, e per tanto ha una maggior probabilità di sfociare in ipotiroidismo. Questa forma raggiunge la sua massima espressione nel mixedema idiopatico dell’adulto.
Il meccanismo eziopatogenetico alla base delle due forme sembra essere, però, lo stesso.
FATTORI DI RISCHIO
– Genetici: è’ dimostrata una associazione significativa tra la tiroidite di Hashimoto e alcuni antigeni di istocompatibilita’ (HLA-DR, HLA-DR5 e alcuni alleli di DQ).
Inoltre la tiroidite di Hashimoto insorge con maggior frequenza in soggetti affetti da sindrome di Down o con disgenesia gonadica (Turner, Klinefelter), facendo supporre che altri geni possano essere coinvolti nella patogenesi.
Probabilmente, però, alla base dello sviluppo della tiroidite autoimmune vi è una suscettibilità poligenica in cui si possono chiamare in causa anche geni non HLA-relati; per esempio determinati polimorfismi del gene CTLA4 sono associati alla possibilità di sviluppare anticorpi antitiroide.
– Gravidanza: una percentuale variabile dall’8% al 10% delle donne in gravidanza sviluppa una tiroidite autoimmune che ha le stesse caratteristiche della tiroidite di Hashimoto dalla quale si differenzia solamente per l’aspetto transitorio.
– Iodio e sostanze contenenti iodio: queste hanno la capacita’ di far precipitare un processo autoimmune nei soggetti predisposti. Il meccanismo di questo fenomeno non è ancora molto chiaro, ma si pensa che l’aumentato grado di iodazione della tireoglobulina aumenti anche la sua antigenicità, così come molti peptidi responsabili della risposta immune linfocitaria sono molto più antigenici quando sono iodati.
– Citochine: il trattamento con IL-2 o interferone a può precipitare la comparsa della patologia autoimmune, soprattutto in soggetti predisposti.
– Irradiazione: la comparsa di anticorpi antitiroide avviene molto più frequentemente dopo l’esposizione a basse dosi radiazioni, come si è visto dopo il disastro di Chernobyl.
– Età: la prevalenza della patologia tende ad aumentare con l’età.
– Sesso: la prevalenza della patologia è maggiore nel sesso femminile e quindi probabilmente fattori ormonali possono concorrere alla patogenesi di questa patologia autoimmune.
– Infezioni: non ci sono evidenze dirette che infezioni causino tiroiditi autoimmuni negli esseri umani. Negli animali, però, diverse infezioni virali possono precipitare una tiroidite autoimmune. Inoltre si è visto che in pazienti con pregressa tiroidite sub-acuta si può sviluppare a lungo termine una disfunzione autoimmune tiroidea, come se un insulto di tipo infettivo sia necessario per precipitare l’autoimmunità tiroidea in soggetti predisposti.
Occorre comunque tenere ben distinti i fattori eziopatogenetici, in grado di modificare la risposta immune, da quelli non patogeneticci che invece sono in grado, solamente, di slatentizzare la malattia.
CLINICA
Frequente è la comparsa di gozzo, che avviene solitamente in modo graduale, indolente senza provocare disturbi al paziente, e sebbene lo sviluppo di atrofia tiroidea dovrebbe essere il risultato finale della distruzione autoimmune della ghiandola, la progressione del gozzo verso lo stato atrofico non è di così comune riscontro.
In conclusione, quindi, il volume tiroideo puo’ essere aumentato (gozzo), come avviene nella maggior parte dei casi, normale o ridotto come avviene nella forma atrofica.
Nella tiroidite di Hashimoto si possono riscontrare diverse situazioni funzionali:
1) normale funzione tiroidea; 2) ipotiroidismo subclinico; 3) ipotiroidismo clinico; 4)ipertiroidismo/tireotossicosi transitoria.
La storia naturale della tiroidite cronica è, solitamente, caratterizzata da una lenta progressione verso l’ipotiroidismo clinico e tale progressione è maggiore nei maschi che nelle femmine, anche se altri fattori intercorrenti possono interferire e modificare il decorso della storia naturale della patologia.
Spesso i pazienti sono asintomatici, se si esclude la presenza di un lieve gozzo. Nel paziente da lungo tempo affetto da tiroidite cronica, invece, i disturbi clinici avverti sono quelli tipici dell’ ipotiroidismo. Rara, anche se possibile, e la comparsa di ipertiroidismo (Hashitossicosi) o di tireotossicosi (nella tiroidite silente) dovuta al rilascio di ormoni tiroidei da parte della tiroide distrutta.
Occasionalmente può essere presente un’oftalmopatia simile a quella che si può riscontrare nel morbo di Basedow.
Spesso le tiroiditi croniche si associano ad altre patologie autoimmuni organo e non-organo specifiche (come gastrite cronica atrofica, anemia perniciosa, anemia emolitica autoimmune, ipoparatiroidismo, vitiligine, diabete mellito tipo 1, morbo di Addison, miastenia gravis, celiachia etc.). Questo fenomeno può essere una semplice associazione di patologie autoimmuni o può configurare un quadro più complesso di sindrome polighiandolare autoimmune.
Pertanto nel caso di tiroidite di Hashimoto è sempre opportuno ricercare altri segni o sintomi correlabili ad altre patologie autoimmuni eventualmente associate.
Inoltre, le tiroiditi croniche hanno un maggior rischio di sviluppo di neoplasie quali il carcinoma differenziato della tiroide e il linfoma. Pertanto va sempre sospettato lo sviluppo di una neoplasia tiroidea in un paziente con tiroidite cronica, in cui, in corso di terapia sostitutiva, si osserva la comparsa di un nodulo o se il volume ghiandolare aumenta rapidamente. Va ricordato, però, che la presenza di tiroidite di Hashimoto è un fattore prognostico favorevole in un paziente con un carcinoma papillifero.
DIAGNOSI
La diagnosi si basa su dati di laboratorio che evidenziano la presenza di elevati valori di anticorpi antitiroide associati ad una funzionalità tiroidea che può essere estremamente variabile in base allo stadio della malattia (normale funzione tiroidea; ipotiroidismo subclinico; ipotiroidismo clinico; ipertiroidismo transitorio). L’assenza degli autoanticorpi è una evenienza rara (5%).
E in tal caso la diagnosi deve essere sostenuta dal quadro ecografico e/o dal citoaspirato.
Inoltre, gli anticorpi anti tiroide che, nella tiroidite di Hashimoto sono presenti a titoli elevati, possono essere presenti, però, con titoli più bassi, anche in soggetti non affetti da tiroidite cronica. Negli adolescenti affetti da tiroidite cronica, inoltre, il livello degli anticorpi antitiroide può non essere così elevato e pertanto la diagnosi può essere più difficile.
Normalmente nella tiroidite di Hashimoto gli anticorpi anti TPO sono presenti molto più frequentemente che quelli anti tireoglobulina.
L’esame ecografico può essere d’aiuto nell’evidenziare un quadro di tipo infiammatorio, ipoecogeno e disomogeneo, mentre, l’agoaspirato può essere utile soprattutto nella valutazione di noduli e nella diagnosi differenziale di queste lesioni con le neoplasie della tiroide e i linfomi tiroidei.
La curva di captazione e la scintigrafia tiroidea non sono utili nella diagnostica della tiroidite cronica.
TERAPIA
In molti casi non è richiesto nessun trattamento perchè il gozzo è piccolo e il paziente è spesso asintomatico, con livelli di TSH nel range di norma.
Il trattamento sostitutivo con LT4 è obbligatorio quando: 1) viene riscontrato ipotiroidismo franco; 2) in caso di ipotiroidismo subclinico con TSH > 10 U/l ; 3) nelle donne che stanno per iniziare un gravidanza o nei bambini.
Il trattamento sostitutivo con LT4 è consigliato, invece, in soggetti con TSH di 4-10 U/l se hanno gozzo o disturbi clinici riferibili all’ipotiroidismo (astenia, obesità, dislipidemia), perchè è dimostrato il miglioramento di diversi parametri clinici (performance mentale, contrattilità cardiaca, assetto lipidico) in corso di terapia con LT4.
La terapia non e’ invece obbligatoria negli altri casi con TSH normale o TSH appena al di sopra della norma.
Il trattamento deve mirare a riportare il TSH a valori compresi fra 1 e 2 U/l. Il primo controllo va effettuato dopo 1 mese dall’ inizio della terapia; una volta raggiunto il compenso terapeutico è sufficiente monitorare FT3, FT4 e TSH ogni 6-12 mesi.
Durante la terapia nel 50-90% dei casi vi è una riduzione del volume e della consistenza del gozzo, sia per la normalizzazione dl TSH, sia per la riduzione dell’infiltrazione linfocitaria. Si assiste, solitamente, anche ad una riduzione del titolo anticorpale a cui sembra contribuire anche una integrazione con selenio.
Il trattamento con levotiroxina è consigliato, quindi, nel caso di gozzo che comprime la strutture adiacenti. Questo trattamento è efficace se il gozzo è di recente riscontro, mentre potrebbe dare scarsi risultati in un gozzo di vecchia data in cui si è già instaurato un certo grado di fibrosi irreversibile.
Sebbene si tratti di una patologia autoimmune, il trattamento steroideo è sconsigliato per via degli effetti collaterali e in quanto non associato ad un reale vantaggio terapeutico
Il trattamento chirurgico, invece, va intrapreso quando i sintomi compressivi permangono nonostante la terapia sostitutiva con LT4 o quando vi è il sospetto di neoplasia.
- pazienti@enzogiudice.it
- +39 3482575740